Назначение
рН-метры в основном являются приборами, предназначенными для определения величины рН и окислительно — восстановительных потенциалов водных растворов, а также для использования в качестве высокоомного милливольтметра.
Прибором можно производить измерения как методом отбора проб с помощью входящих в комплект датчиков, так и непосредственно в лабораторных установках.
Приборы рассчитаны для использования в научно-исследовательских учреждениях, промышленных предприятиях и различных отраслях народного хозяйства.
На производстве в основном используются рН-метры типа рН-210, рН-215 и др., а также иономеры, предназначенные для определения активности одно- и двухвалентных анионов и катионов (величины рХ) в водных растворах, типа И-120, И-130, И-135 и др.
Принцип измерения величины рН
Для измерения величины рН используется потенциометрический метод анализа, который основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. Измерительный электрод реагирует на ионы водорода, а его потенциал зависит от содержания этих ионов в растворе и подчиняется уравнению Нернста:
Е = Е0 + R×T/F×ln aн = Е0 — 2,3×R×T/F×рН,
где R — универсальная газовая постоянная, равная 8,315 × 107 эрг/C×моль;
Т — температура раствора, К;
F — 96000 кулон/г экв (число Фарадея );
ан — активность ионов водорода в растворе;
рН — величина рН раствора;
Е0 — потенциал стеклянного электрода по отношению к стандартному водородному электроду при ан=1.
Абсолютную величину потенциала в настоящее время измерить невозможно, однако можно измерить потенциал относительно другого электрода, потенциал которого не зависит от состава раствора и условно равен нулю. Такой электрод называется электродом сравнения или вспомогательным электродом.
Таким образом, измерения всегда проводятся при помощи двух электродов: измерительного и электрода сравнения. Кроме того, в настоящее время существуют комбинированные электроды, которые в одном корпусе содержат оба электрода и измерительный, и сравнительный.
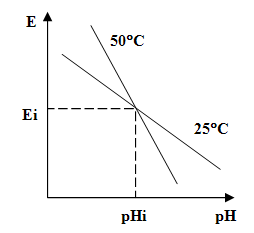 Кроме того следует знать, что электродная функция зависит от температуры раствора. Эта зависимость показана на графике.
Кроме того следует знать, что электродная функция зависит от температуры раствора. Эта зависимость показана на графике.
С увеличением температуры увеличивается наклон (крутизна) электродной характеристики.
Концентрация анализируемых ионов, при которой потенциал электрода не зависит от температуры, называется изопотенциальной точкой.
Значения концентрации раствора и потенциала электрода в этой точке называют координатами изопотенциальной точки.
Для стеклянных электродов координаты изопотенциальной точки нормируются, т.е. указываются изготовителем, а для прочих электродов обычно нет. Современные измерительные приборы позволяют автоматически учитывать температурные изменения электродной характеристики (термокомпенсация), для этого в прибор должны быть введены координаты изопотенциальной точки и текущая температура. Последняя может вводиться либо вручную, либо посредством термодатчика, подключенного к прибору.
При выборе электродов, рекомендуется выбирать такой электрод, изопотенциальная точка которого, лежит вблизи средней концентрации анализируемых растворов.
Рассмотрим измерительную систему со стеклянными измерительным и вспомогательным электродами, схема которой приведена на рисунок 1.
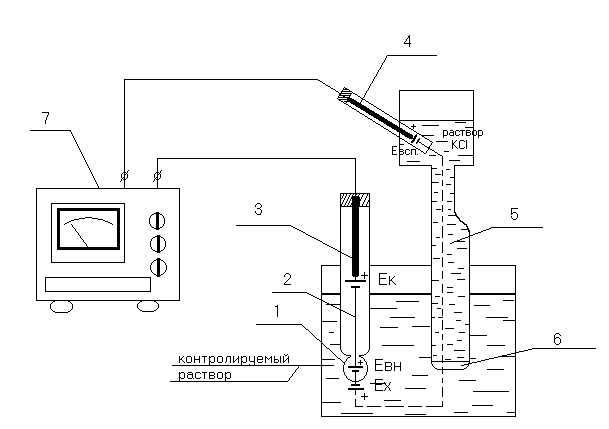
Рисунок 1. Схема измерения величины рН раствора.
1 — полый шарик из электродного стекла; 2 — стеклянный электрод; 3 — внутренний контактный электрод; 4 — вспомогательный электрод; 5 — электролитический ключ; 6 — пористая перегородка; 7 — милливольтметр.
При погружении электрода в раствор между поверхностью шарика 1 стеклянного электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного электрода.
Между поверхностью стекла и контролируемым раствором возникает разность потенциалов Ех, величина которой определяется активностью ионов водорода в растворе и его температурой.
Для создания электрической цепи при измерении применяются контактные электроды: внутренний контактный электрод 3, осуществляющий электрический контакт с раствором, заполняющим внутреннюю часть стеклянного электрода, и внешний контактный электрод (вспомогательный электрод) 4, осуществляющий электрический контакт с контролируемым раствором.
Для защиты от воздействия высоких температур (при измерении рН растворов, температура которых выше температуры окружающего воздуха) вспомогательный электрод помещают вне контролируемого раствора и связь с ним осуществляется с помощью электролитического ключа 5 – трубки, наполненной раствором хлористого калия и заканчивающейся пробкой со стеклянным волокном 6.
Раствор хлористого калия непрерывно просачивается через стеклянное волокно пробки, предотвращая проникновение из контролируемого раствора в систему электрода 4 посторонних ионов, которые могли бы изменить величину потенциала электрода.
Электродвижущая сила электродной системы равна алгебраической сумме потенциалов контактов электродов Ек и Евсп потенциала, возникающего на внутренней поверхности стеклянного электрода и определяемого величиной рН внутреннего раствора Евн и потенциала, возникающего на наружной поверхности стеклянного электрода Ек.
Величины Ек, Евсп, и Евн не зависят от состава контролируемого раствора и меняются только при изменении температуры
Е = Ек + Евсп + Евн + Ех = Е0 — 2,3×R×T/F×рН.
Суммарная электродвижущая сила электродной системы зависит от величины рН раствора.
Измеряя ЭДС электродной системы с помощью милливольтметра, шкала которого градуирована в единицах рН, определяют величину рН контролируемого раствора.
Принцип действия прибора
Электродная система, являющаяся датчиком, имеет большое внутреннее сопротивление, достигающее 500-1000 МОм.
Для измерения ЭДС электродной системы применяется компенсационная схема, позволяющая существенно уменьшить ток, потребляемый от датчика при измерении.
Элементарная схема, поясняющая принцип действия рН-метра, приведена на рисунке 2.
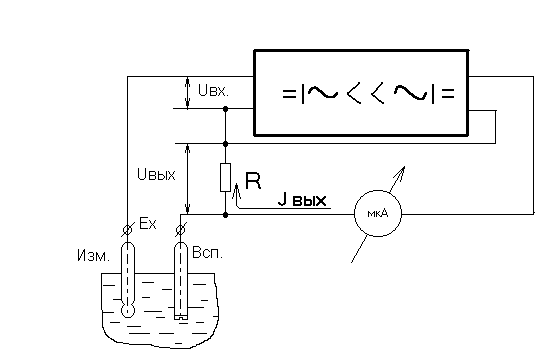
Рисунок 2. Элементарная схема прибора.
ЭДС электродной системы Ех сравнивается с падением напряжения на сопротивлении R, через которое протекает ток Iвых оконечного каскада усилителя. Падение напряжения Uвых на сопротивлении R противоположно по знаку электродвижущей силе Ех, и на вход усилителя подается напряжение: Uвх=Ех-Uвых=Ех-R×Iвых.
Напряжение Uвх преобразуется вибропреобразователем в переменное напряжение, которое затем многократно усиливается и при помощи фазочувствительного детектора вновь преобразуется в постоянное напряжение. Это напряжение управляется током Iвых оконечного каскада усилителя. При достаточно большом коэффициенте усиления усилителя напряжение Uвых мало отличается от ЭДС Ех и благодаря этому ток, протекающий через электроды в процессе измерения ЭДС, весьма мал.
Ток Iвых, протекающий через сопротивление R, пропорционален ЭДС электродной системы и величине рН контролируемого раствора.
Электродная система
Основной характеристикой электродной системы является зависимость ее ЭДС от величины рН и температуры раствора. В общем случае ЭДС может быть выражена уравнением:
Е=Еи-[S20+а(t-20)] (рН-рНи),
где Е — ЭДС в милливольтах;
t — температура электродов;
рН — величина рН раствора;
рНи — величина рН раствора, соответствующая изопотенциальной точке;
S20 — крутизна характеристики в изопотенциальной точке;
а — температурный коэффициент крутизны.
Зависимость ЭДС электродной системы рН и температуры может быть представлена следующим приближенным уравнением:
Е=-33-(54,196+0,1884t) (рН-3,28)